Home / Retos actuales / Los métodos de triaje son clave
Retos actuales
Los métodos de triaje son clave

La genotipificación extendida y la citología base líquida elevan el triaje del cáncer cervicouterino a un nivel superior.¹⁻⁴
En el enfoque de tamizaje inicial del VPH, si la prueba da positivo, se hace un análisis adicional para decidir el tratamiento adecuado. Este análisis ayuda a determinar si se necesita una colposcopia con biopsia, tratamiento o solo un seguimiento.⁵
Después de una prueba positiva de VPH, hay diferentes análisis disponibles, como genotipificación, pruebas citológicas, inspección visual con ácido acético (IVA) o colposcopia.⁵

Al elegir una prueba de clasificación confiable tras un resultado positivo para el VPH, los médicos pueden detectar mejor lesiones precancerosas y mujeres con mayor riesgo de enfermedad cervical. Esto también ayuda a reducir la necesidad de colposcopias y tratamientos innecesarios para mujeres con menor riesgo.¹⁻⁴
La genotipificación del VPH especialmente el extendido, ofrece información sobre el riesgo presente y futuro de cáncer cervicouterino en las mujeres, y puede integrarse en la primera prueba VPH.¹,²,⁵
La prueba de Papanicolaou base líquida utiliza un método de recolección de muestras estandarizado que mejora la calidad de las muestras y la detección de lesiones cervicales.³,⁴ Además, se puede realizar en la misma muestra que la prueba inicial de VPH.



La genotipificación extendida está avanzando en las pruebas de VPH y mejorando la gestión clínica al ofrecer información específica y procesable, reduciendo las llamadas de los pacientes y las colposcopias innecesarias.¹
Hay 12 genotipos de VPH de alto riesgo identificados como oncogénicos:
16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59.⁶
Sin embargo, los genotipos del VPH varían en prevalencia, y en su capacidad para causar lesiones cervicales.¹,²,⁶
Los VPH 16 y 18 son responsables de aproximadamente el 74% de todos los casos de cáncer cervicouterino y han sido el objetivo de la vacunación desde 2006.⁶,⁷
Los VPH 16, 31, 51, 52 y 18 son los genotipos más comunes en mujeres europeas con citología normal (en orden de prevalencia).⁶
Los VPH 16, 18, 33, 45 y 31 son los genotipos más frecuentemente asociados con el cáncer de cervicouterino (en orden de prevalencia).⁶
Los VPH 16, 31, 33, 52 y 18 son los genotipos más frecuentemente asociados con lesiones cervicales de alto grado en Europa (en orden de prevalencia).⁶
Pero no todas las pruebas de VPH son equivalentes. Al identificar qué genotipo del VPH está presente, la genotipificación extendida del VPH puede estratificar el riesgo de NIC3+ para ayudar a guiar la decisión clínica.¹,⁸
En este aspecto, la citología y la genotipificación parcial proporcionan información restringida para la evaluación del verdadero riesgo clínico.⁸
Comparación de la genotipificación para la Detección del VPH

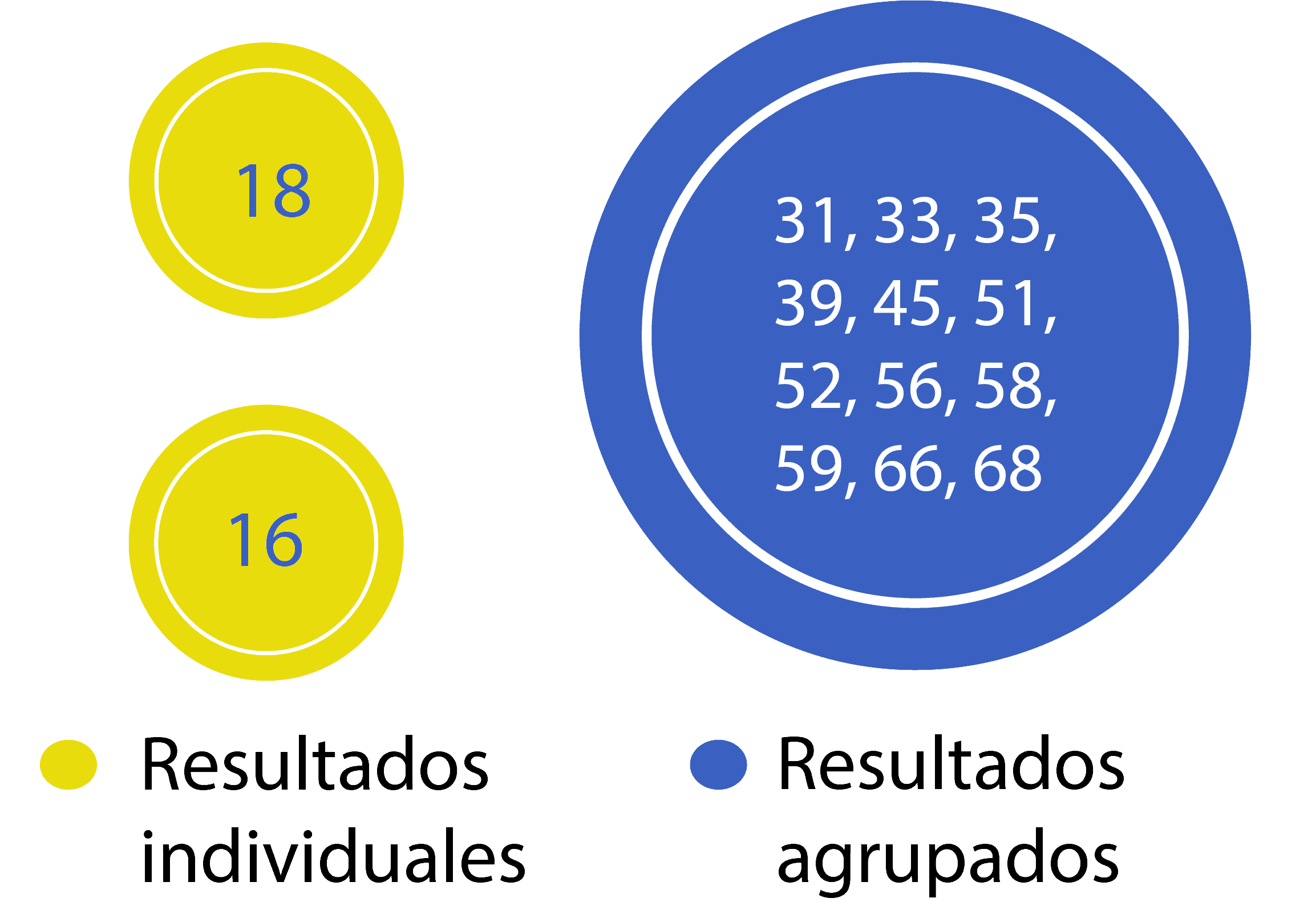
Las pruebas de VPH con la genotipificación parcial informan múltiples genotipos de VPH en un solo resultado,¹ lo que puede:
- Enmascarar el verdadero riesgo de precáncer por VPH 31, 33, 45, 52 o 58.²
- Prohibir el seguimiento de la persistencia del VPH de genotipo específico más allá de los VPH 16 y 18.²
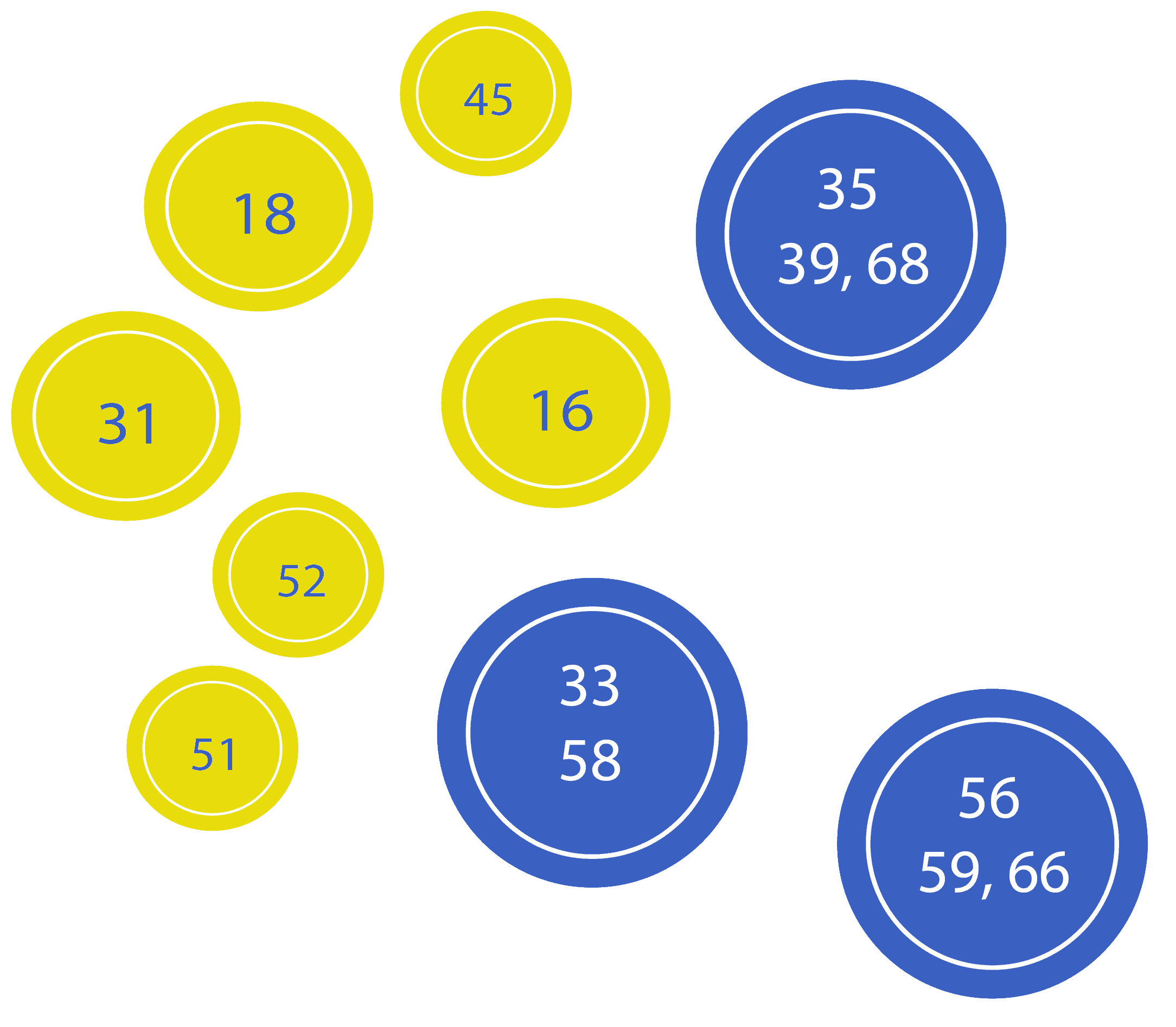
- Proporciona información relevante y elimina la necesidad de realizar pruebas adicionales gracias a la identificación de 31, 33, 45, 52 o 58.¹’²
- Realizar un seguimiento de la persistencia del VPH² de genotipo específico, siendo el determinante de riesgo más importante de cáncer cervicouterino en mujeres con pruebas positivas de VPH.⁹’¹⁰
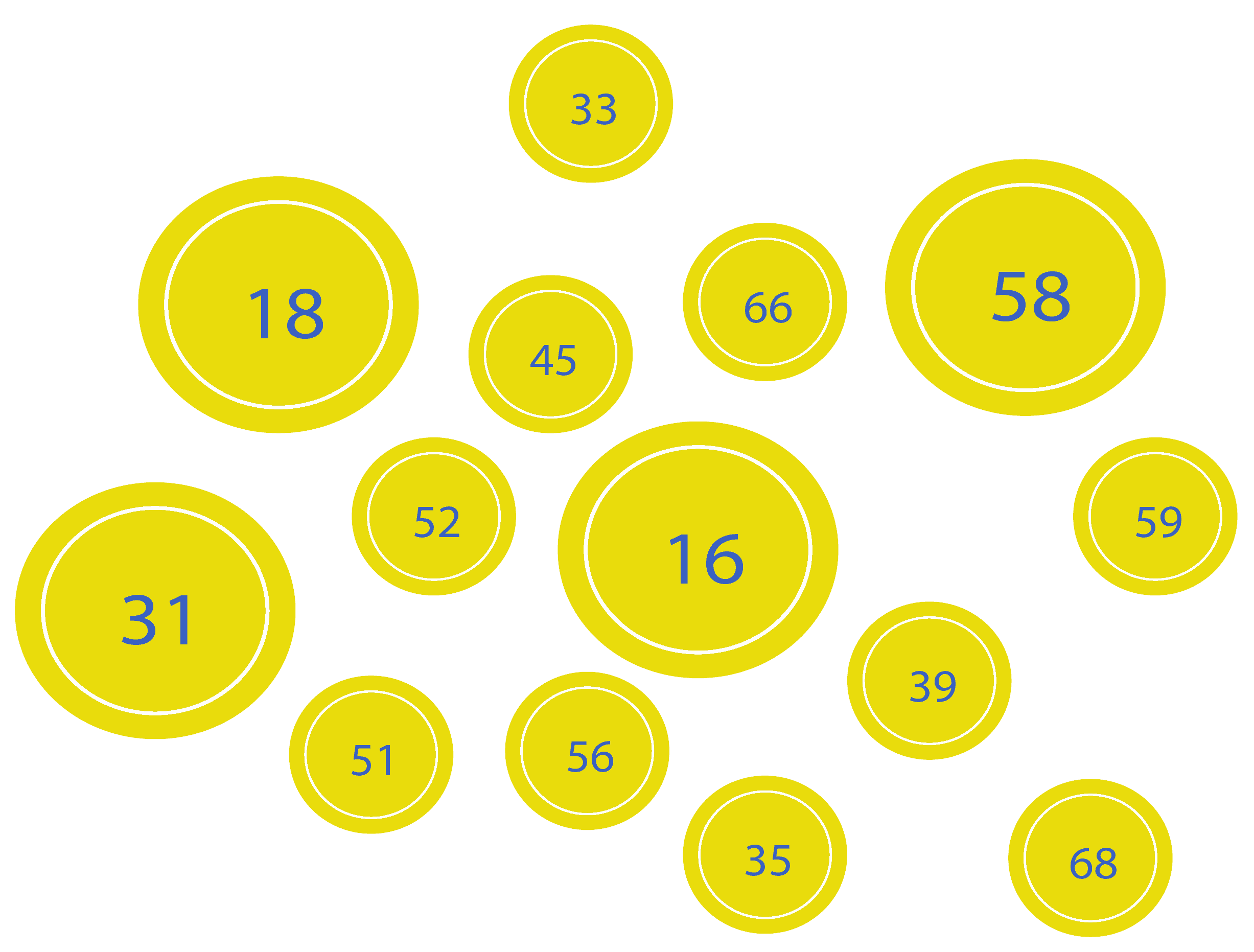
Agrupar los genotipos del VPH en grupos puede facilitar la implementación de la información de las pruebas del VPH en los algoritmos de detección, ya que simplifica el manejo clínico.¹,⁸,¹¹
Cómo podría ser la gestión diferenciada de pacientes en el futuro*¹²
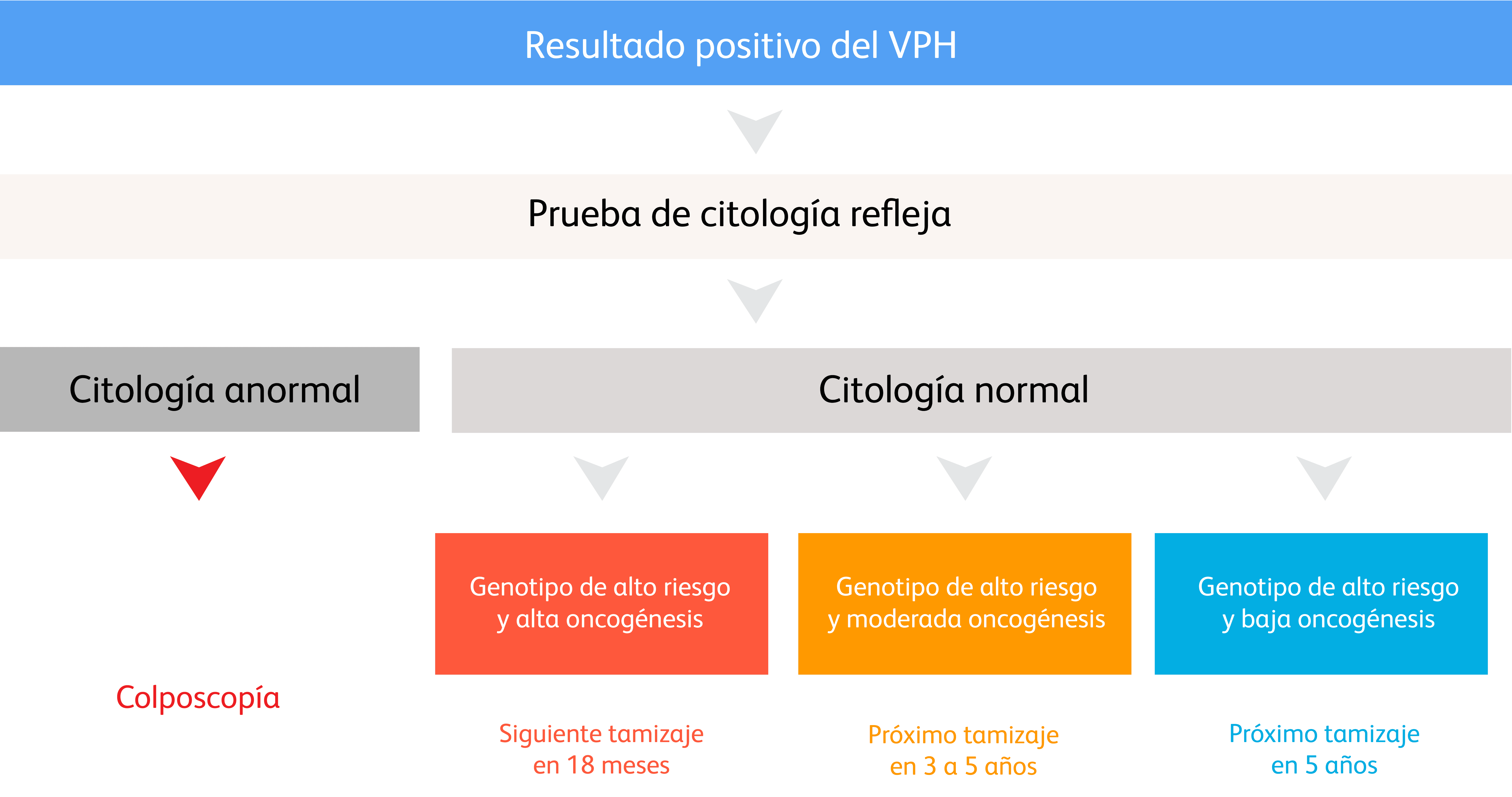



La citología base líquida ha revolucionado la prueba de Papanicolaou al mejorar significativamente la calidad de las muestras y la detección de lesiones cervicales y reducir las llamadas de los pacientes al mismo tiempo que mejora la rentabilidad.³,⁴
La incidencia y la mortalidad del cáncer de cuello uterino han disminuido en un 70% desde la introducción de la prueba de Papanicolaou en los países desarrollados con programas de detección bien establecidos y en los que las mujeres se someten a pruebas de detección a intervalos regulares.¹⁵
Sin embargo, no todas las pruebas de Papanicolaou son iguales. La prueba de Papanicolaou convencional tiene muchas limitaciones que pueden dar lugar a imprecisiones y diagnósticos equívocos.¹⁶
Comparación de citología convencional y base líquida.³,⁴
 |
 |
|
|---|---|---|
| Principio | El contenido del cepillo se aplica directamente sobre el portaobjetos. |
|
| Toma de muestra estandarizada |  Variabilidad en la recolección de muestras |
 |
| Preparación de la laminilla | Manual | Automatizado |
| Poco o nulo material biológico que impida la visibilidad |  |
 |
| Fácil evaluación de la laminilla |  |
 |
| Reducción del tiempo de la prueba |  |
 |
| Desempeño | Informes no concluyentes frecuentes |
|
| Pruebas adicionales |  No siempre es posible |
|

La prueba de Papanicolaou base líquida BD SurePath™ supera a los métodos de citología convencionales y a otros métodos de citología base líquida ⁴,¹⁷,¹⁸
Retos actuales
Citología base líquida BD SurePath™
Soluciones BD
*Algoritmo hipotético de gestión de pacientes, adaptado del nuevo algoritmo de detección propuesto para el programa nacional de prevención del cáncer cervicouterino en Suecia.¹²
† Dependiendo de la edad y otros factores, es posible que algunos genotipos de VPH poco oncogénicos no requieran pruebas citológicas.¹²
‡ Dependiendo de la edad y otros parámetros clínicos.¹²
ASC-US, células escamosas atípicas de significado indeterminado; NIC3+, neoplasia intraepitelial cervical grado 3 o superior; FDA, Administración de Alimentos y Medicamentos; hr, alto riesgo; VPH, virus del papiloma humano; CBL, citología base líquida; Papanicolaou.
Referencias
1. Bonde JH et al. J Low Genit Tract Dis. 2020;24(1):1–13.
2. Stoler MH et al. Gynecol Oncol. 2019;153(1):26–33.
3. Hoda RS et al. Diagn Cytopathol. 2013;41(3):257–78.
4. Rozemeijer K et al. BMJ. 2017;356:j504.
5. World Health Organization. WHO Guideline for Screening and Treatment of Cervical Pre-Cancer Lesions for Cervical Cancer Prevention – Second Edition. 2021.
6. ICO/IARC Information Centre on HPV and Cancer (HPV Information Centre). Human Papillomavirus and Related Diseases in Europe. Summary Report. 2021.
7. European Medicines Agency. Gardasil Product information. 2022.
8. Gilham C et al. Health Technol Assess. 2019;23(28):1-44.
9. Bodily J and Laimins LA. Trends Microbiol. 2011;19(1):33–9.
10. Elfgren K et al. Am J Obstet Gynecol. 2017;216(3):264.e1–7.
11. Demarco M et al. EClinicalMedicine. 2020;22:100293.
12. Regionala cancercentrum i samverkan. Cervixcancerprevention. Nationellt vårdprogram. Remissversion. Version: 4.0. Last updated 19 Apr 2022. Accessed 10 Oct 2022. Available at: https://cancercentrum.se/globalassets/vara-uppdrag/kunskapsstyrning/vardprogram/kommande-vardprogram/2022/220419/nationellt-vardprogram-livmoderhalscancerprevention-remissversion.pdf.
13. Arbyn M et al. Clin Microbiol Infect. 2021;27(8):1083–95.
14. Salazar KL et al. J Am Soc Cytopathol. 2019;8(5):284–92.
15. Bedell SL et al. Sex Med Rev. 2020;8(1):28–37.
16. Gibb RK and Martens MG. Rev Obstet Gynecol. 2011;4(Suppl 1):S2–S11.
17. Fremont-Smith M et al. Cancer. 2004;102(5):269–79.
18. Nance KV. Diagn Cytopathol. 2007;35(3):148–53.



