Home / Desafios Atuais / A mudança para a triagem primária de HPV requer testes confiáveis de HPV
Desafios Atuais
A mudança para o rastreio primário do HPV requer testes de HPV confiáveis
As diretrizes oficiais recomendam a detecção primária do HPV para a prevenção do câncer de colo do útero.
A introdução da triagem baseada na citologia (ou teste de Papanicolau) na década de 1940 contribuiu grandemente para a redução da mortalidade por câncer de colo do útero.¹,²
Hoje em dia, devido à sua comprovada superioridade clínica na prevenção do câncer de colo do útero, a OMS recomenda fortemente o teste primário do HPV em vez da citologia para programas de detecção.²
A detecção baseada no HPV, em comparação com a detecção baseada na citologia, proporciona maior proteção contra o câncer invasivo, permite intervalos de detecção mais longos para mulheres com resultados negativos e respalda a autocoleta.³⁻⁶
Escolha o teste de diagnóstico BD Onclarity™ HPV.
A mudança para a triagem primária do HPV torna essencial a utilização de testes confiáveis de HPV que sejam clinicamente validados para intervalos de detecção mais longos e aprovados para utilização com amostras e em uma população vacinada.
Flexibilidade no paradigma de
triagem e tipo de amostra.
Resultados nos quais você pode confiar.
A triagem primária do HPV oferece:


Proteção entre 60% a 70% maior contra o câncer invasivo em comparação com o rastreamento baseado em citologia.⁷

Maior proteção a longo prazo contra o câncer de colo do útero, mesmo em populações vacinadas.⁷,⁸
A genotipagem estendida pode melhorar o tratamento clínico, fornecendo conhecimentos específicos e práticos para ajudar a reduzir chamadas de pacientes e colposcopias desnecessárias.⁹
Melhorando o tratamento de pacientes com genotipagem estendida
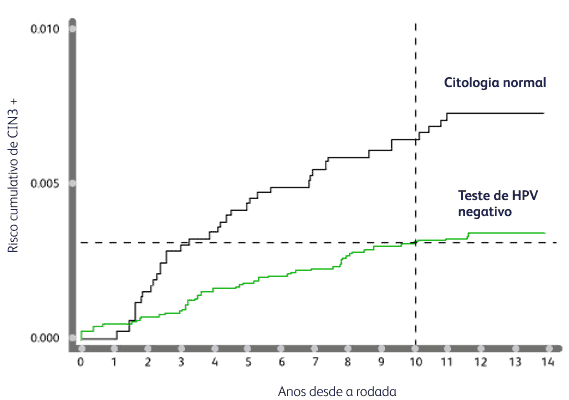
Risco acumulado de NIC3+ após um teste de HPV negativo ou uma citologia normal na admissão.¹⁰
O risco acumulado de NIC3+ é semelhante 10 anos após um teste de HPV negativo e 3 anos após uma citologia negativa (0,3%).¹⁰
Adaptado de Gilham C et al. 2019.¹⁰
Um intervalo de detecção de até 10 anos com o teste primário do HPV mostra maiores benefícios do que a detecção baseada em citologia.²,¹¹
A autocoleta pode potencialmente ampliar a cobertura de detecção, aumentando as taxas de participação e representa uma oportunidade única de expansão para populações de difícil acesso.⁵,⁶


O teste do HPV em amostras autocolhidas é parte integrante da estratégia para eliminar o câncer de colo do útero como um problema de saúde pública na Europa para mulheres que não se submeteram a testes de detecção ou que não o realizaram.⁵
Mais mulheres sendo examinadas significa menos casos de câncer de colo do útero.⁶,¹²
A importância da autocoleta.
A superioridade da triagem primária do HPV também é observada em uma população altamente vacinada,⁸ o que respalda a estratégia global da OMS de programas combinados de vacinação e triagem.²
Existem três tipos diferentes de vacinas contra o HPV:
- Protege contra os genótipos16 e 18 do HPV de alto risco.¹⁴,¹⁵
- Aprovado inicialmente pela EMA em 2007 e pela FDA em 2009.¹⁴,¹⁵
- Retirada voluntária dos EUA em 2016.
- Protege contra dois genótipos do HPV de alto risco (HPV 16 e 18 ) e dois genótipos de baixo risco* (HPV 6 e 11).¹⁶,¹⁷
- Aprovado inicialmente pela EMA e FDA em 2006.¹⁶,¹⁷
- Não é mais distribuído nos EUA.
- Tem como alvo os mesmos genótipos da vacina quadrivalente e cinco genótipos adicionais de HPV de alto risco: HPV 31 , 33 , 45 , 52 e 58.¹⁸,¹⁹
- Aprovado pela FDA em 2014 e pela EMA em 2015.¹⁸,¹⁹
Embora a vacina nonavalente contra o HPV seja agora utilizada exclusivamente em muitos países, as mulheres que receberam as vacinas anteriores passaram agora a fazer parte da população de detecção.
Além disso, à medida que a população vacinada aumenta, a prevalência do HPV 16 e 18 (genótipos de alto risco abrangidos pelas vacinas bivalente, 4-valente e 9-valente) está diminuindo.²⁰
A vacinação contra o HPV está constantemente remodelando o panorama do HPV. O teste do genótipo do HPV continua sendo uma ferramenta importante para ajudar a estratificar o risco e melhorar o tratamento da paciente.²⁰
A genotipagem expandida
Pode ajudar a monitorar mudanças na prevalência de genótipos de alto risco.

A vacina ção é uma ferramenta valiosa
As mulheres não estão protegidas contra todos os GENÓTIPOS de HPV.

Redução dos genótipos do HPV em adolescentes
Uma cobertura vacinal de 50% em meninas de 13 a 19 anos reduziu os genótipos 16 e 18 em 83% e os genótipos 31, 33 e 45 em 54%.²

Impacto na vacinação
À medida em que a população vacinada aumenta, a prevalência dos HPVs 16 e 18 está diminuindo.²⁰
O que mais a genotipagem estendida pode fazer pelos seus pacientes?
A BD apoia a mudança para o teste de HPV como um teste de detecção primária com um teste de HPV preciso e um método de classificação confiável para ajudar ainda mais a orientar o manejo do paciente com precisão.
Métodos de classificação confiáveis
Desafios atuais
Ensaio de HPV BD Onclarity™
Citologia em base líquida BD SurePath™
Soluções BD
*De acordo com o conhecimento científico atual, os HPV 6 e 11 são responsáveis pelas verrugas genitais e não estão envolvidos na doença cervical.
NIC2+, neoplasia intraepitelial cervical grau 2 ou superior; NIC3+, neoplasia intraepitelial cervical grau 3 ou superior; EMA, Agência Europeia de Medicamentos; FDA, Administração de Alimentos e Medicamentos; HPV, papilomavírus humano; hr, alto risco; Pap, Papanicolau; PCR, reação em cadeia da polimerase; Estados Unidos, Estados Unidos; OMS, Organização Mundial de Saúde; xGT, genotipagem expandida.
Referências:
1. Adegoke O et al. J Womens Health. 2012;21(10):1031–7.
2. World Health Organization. WHO Guideline for Screening and Treatment of Cervical Pre-Cancer Lesions for Cervical Cancer Prevention – Second Edition. 2021.
3. Marth C et al. Ann Oncol. 2017;28(Suppl 4):iv72–iv83.
4. Maver PJ and Poljak M. Clin Microbiol Infect. 2020;26(5):579–83.
5. Arbyn M et al. Int J Cancer. 2021;148(2):277–84.
6. Lozar T et al. Int J Womens Health. 2021;13:841–59.
7. Ronco G et al. Lancet. 2014;383(9916):524-32.
8. Canfell K et al. PLOS Med. 2017;14(9):e1002388.
9. Bonde JH et al. J Low Genit Tract Dis. 2020;24(1):1–13.
10. Gilham C et al. Health Technol Assess. 2019;23(28):1-44.
11. European Commission. European Guidelines for Quality Assurance in Cervical Cancer Screening – Second Edition, Supplements. 2015.
12. Arbyn M et al. BMJ. 2018;363:k4823.
13. Rohner E et al. J Clin Microbiol. 2020;58(3):e01443-19.
14. European Medicines Agency. Cervarix Product information. 2021.
15. Food and Drug Administration. Cervarix Package insert.
16. European Medicines Agency. Gardasil Product information. 2022.
17. Food and Drug Administration. Gardasil Package insert.
18. European Medicines Agency. Gardasil 9 Product information. 2022.
19. Food and Drug Administration. Gardasil 9 Package insert.
20. Wright TC et al. Gynecol Oncol. 2019;153(2):259–65.
21. European Centre for Disease Prevention and Control. Guidance on HPV vaccination in EU countries: focus on boys, people living with HIV and 9-valent HPV vaccine introduction. 2020.